1- Obtenção e Oxidação do Acetileno
Direcionado ao terceiro ano do ensino mádio.
OBJETIVO: Obter hidrocarboneto e realizar a sua oxidação.
INTRODUÇÃO
A química orgânica exerce grande participação no nosso cotidiano. Grande parte dos compostos produzidos em todos os seres vivos, sejam eles vegetais ou animais, é orgânica. Por exemplo, temos a uréia e a glicose. Também a encontramos os compostos orgânicos no combustível, na produção de tinta e sabões e até mesmo em medicamentos.
Além do ar que respiramos que contém oxigênio (O2) e da água que constitui cerca de 70% do nosso corpo, há um átomo que é fundamental, o Carbono. É dos compostos desse elemento que a química orgânica trata. Todo composto orgânico apresenta o elemento carbono, mas nem todo composto que apresenta carbono pode ser classificado como orgânico. Um exemplo disso é o dióxido de carbono (CO2), que
pelas suas propriedades físicas e químicas é classificado como um óxido inorgânico.
Os compostos orgânicos podem participar de vários tipos de reação, dentre elas a oxidação, onde o carbono tem seu estado de oxidação alterado. Dentro dessa classe de reações podemos destacar:
• combustão completa, onde o material orgânico é queimado na presença de oxigênio e como resultado obtém-se dióxido de carbono (CO2) e água.
• combustão incompleta, resultando em diferentes produtos como monóxido de carbono (CO), fulígem (Cs) e vapor de água.
Um exemplo de combustão completa é a envolvendo o gás butano, abaixo apresentada.
C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
É importante destacar que alguns materiais entram em combustão sem fonte externa de calor, denominando assim uma combustão espontânea, gerada de maneira natural, podendo ser pela ação de bactérias que fermentam materiais orgânicos produzindo calor e liberando gases. O
processo fisiológico pelo qual os organismos vivos inalam oxigênio do meio e liberam dióxido de carbono é chamado de respiração. Este nome também é utilizado para nomear o processo pelo qual as células liberam energia, procedente da combustão de moléculas como os carboidratos e
as gorduras. O dióxido de carbono e a água são os produtos que resultam deste processo, chamado respiração celular para distingui-lo do processo fisiológico global da respiração.
Nos animais e plantas, o alimento é o combustível, consideramos a glicose (C6H12O6) o mais importante.
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
INTRODUÇÃO
O acetileno é o nome usualmente empregado para o alquino, gás etino que possui cheiro intenso e desagradável. É produzido pela reação do carbeto de cálcio (ou carbureto - CaC2(s) ) com a
água.
CaC2 + 2 H2O → Ca(OH)2 + HC ≡ CH
carbeto de cálcio, hidróxido de cálcio e acetileno
O acetileno tem como propriedade característica a capacidade de liberar grandes quantidades de calor durante sua combustão - reação com o oxigênio (O2). Nos maçaricos de oxiacetileno, o acetileno
QUÍMICA ORGÂNICA
Reação de Oxidação
1- Obtenção e Oxidação do Acetileno
reage com oxigênio puro produzindo dióxido de carbono (CO2) e água (H2O) e a chama obtida pode alcançar a temperatura de 2.800ºC. Por esse motivo ele é muito usado em processos de solda de metais que exigem temperaturas elevadas. O gás acetileno também é muito utilizado por exploradores de cavernas nas lanternas de carbureto onde uma grande quantidade do gás é produzida a partir de uma pequena quantidade de carbureto, o que possibilita o funcionamento da lanterna por longo período. O acetileno pode ser empregado também na síntese de muitos compostos orgânicos como ácido acético, plásticos e borrachas sintéticas, porém tem sido substituído em sínteses orgânicas pelo
etileno devido ao seu custo. Por meio de processos ainda não muito conhecidos, este gás age no amadurecimento de frutas, porém menos eficientemente que o etileno.
MATERIAL E REAGENTES
• 3 tubos de ensaio
• suporte para tubos de ensaio
• rolha acoplada a mangueira
• potinho dosador
• misturador
• solução de permanganato de potássio
(KMnO4) 0,5 g/L
• carbeto de cálcio (CaC2)
• fenolftaleína
PROCEDIMENTO
Inserir os tubos de ensaio nas posições A, B e C
 identificadas no suporte.
identificadas no suporte.Colocar água nos tubos de ensaio até aproximadamente 1/8 dos seus
volumes. Nos tubos A e B adicionar 5 gotas de solução de permanganato
de potássio e reservar o tubo C como branco.
Adicionar uma medida do misturador de carbeto de cálcio no tubo de
ensaio A e tampá-lo rapidamente. Introduzir a extremidade da mangueira na solução de permanganato de potássio do tubo B, como mostra a figura, até observar modificação da solução. Retirar a mangueira e a rolha dos tubos. A seguir, adicionar 3 gotas de fenolftaleína no tubo A.
Observar cada uma das soluções, anotar e explicar o que ocorreu.
Estudando a reação que ocorreu no tubo A
a. Quais são os reagentes? Escrever as respectivas fórmulas químicas. (Lembre-se que a
fenolftaleína é um indicador e não participa da reação).
b. Após adição da fenolftaleína houve mudança de cor da solução indicando a formação de uma base. Escrever a fórmula química desta base.
c. Houve também uma efervescência, indicando a formação de um gás. Qual é a fórmula química deste gás?
d. Organizar as informações acima e escrever a equação química que representa a reação química que ocorreu no tubo A.
Estudando a reação que ocorreu no tubo B
a. Quais são os reagentes? Escrever as respectivas fórmulas químicas.
b. Após a reação houve mudança de cor da solução de permanganato de potássio? Justificar.
c. Organizar as informações e escrever a equação química que representa a reação que ocorreuno tubo B.
http://educar.sc.usp.br/experimentoteca/quimica/8orgreacoxidg_1.pdf
 As proteínas podem ter propriedades e atividades totalmente diferentes pelas diversas combinações e seqüências dos 20 aminoácidos existentes. Basta uma única mudança em qualquer dos aminoácidos de uma seqüência para se ter uma nova proteína.
As proteínas podem ter propriedades e atividades totalmente diferentes pelas diversas combinações e seqüências dos 20 aminoácidos existentes. Basta uma única mudança em qualquer dos aminoácidos de uma seqüência para se ter uma nova proteína.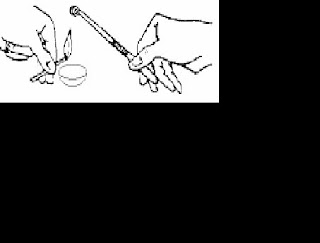













 existe um grande interesse no desenvolvimento de técnicas para a manipulação de células-tronco, no intuito de instituirem-se tratamentos restauradores de tecidos e órgãos. Para que a bioengenharia seja eficaz, faz-se necessária a presença de três fatores: as próprias células-tronco, uma matriz extracelular e fatores de crescimento. Existem inúmeros fatores de crescimento envolvidos no desenvolvimento do órgão dentário. Por isso pesquisadores ainda não foram capazes de formar um órgão completo, embora existam diversos estudos evidenciando a formação de esmalte e dentina a partir de células-tronco isoladas da polpa dentária. Recentemente, também foram isoladas células-tronco da polpa dos dentes decíduos. Sabe-se que estas células são altamente proliferativas, sendo de grande importância para o cirurgião-dentista o conhecimento do seu comportamento biológico e técnicas de obtenção.
existe um grande interesse no desenvolvimento de técnicas para a manipulação de células-tronco, no intuito de instituirem-se tratamentos restauradores de tecidos e órgãos. Para que a bioengenharia seja eficaz, faz-se necessária a presença de três fatores: as próprias células-tronco, uma matriz extracelular e fatores de crescimento. Existem inúmeros fatores de crescimento envolvidos no desenvolvimento do órgão dentário. Por isso pesquisadores ainda não foram capazes de formar um órgão completo, embora existam diversos estudos evidenciando a formação de esmalte e dentina a partir de células-tronco isoladas da polpa dentária. Recentemente, também foram isoladas células-tronco da polpa dos dentes decíduos. Sabe-se que estas células são altamente proliferativas, sendo de grande importância para o cirurgião-dentista o conhecimento do seu comportamento biológico e técnicas de obtenção.

 O câncer de pele que se origina de sinais escuros ou pode se assemelhar a pintas e sinais é conhecido por Melanoma Maligno. Se não detectado e tratado, é um dos mais mortais tipos de câncer. ‘‘Se detectado e tratado precocemente, pode ser curado em grande parte dos casos’’, afirma o dermatologista Francisco Leite. Segundo ele, o paciente deve desconfiar das pintas e sinais que tiverem as seguintes características: 1) formas irregulares; 2) bordas mal-delimitadas; 3) coloração em tons variados de preto ou marrom escuro; 4) diâmetro maior ou igual a 6 milímetros; e 5) evolução suspeita com coceira, dor ou sangramento.
O câncer de pele que se origina de sinais escuros ou pode se assemelhar a pintas e sinais é conhecido por Melanoma Maligno. Se não detectado e tratado, é um dos mais mortais tipos de câncer. ‘‘Se detectado e tratado precocemente, pode ser curado em grande parte dos casos’’, afirma o dermatologista Francisco Leite. Segundo ele, o paciente deve desconfiar das pintas e sinais que tiverem as seguintes características: 1) formas irregulares; 2) bordas mal-delimitadas; 3) coloração em tons variados de preto ou marrom escuro; 4) diâmetro maior ou igual a 6 milímetros; e 5) evolução suspeita com coceira, dor ou sangramento.